
IEX
Cytiva(싸이티바) IEX는 단백질 표면의 순전하 차이에 기초하여 단백질을 분리합니다. 전하를 띤 단백질과 반대의 전하를 가진 크로마토그래피 레진 간의 가역적인 상호작용을 기초로 분리합니다.
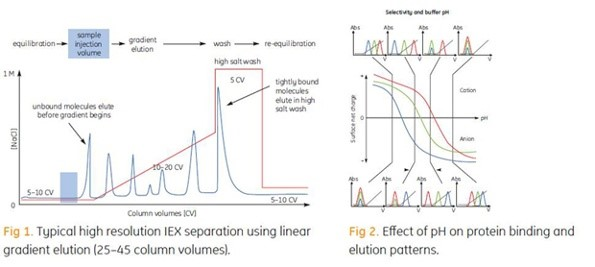
컬럼 내에 단백질을 주입하면 단백질이 결합됩니다. 그 후 조건이 변화되면 결합된 물질들이 차별적으로 용출됩니다. 이러한 용출은 보통 염농도의 증가나 pH 변화에 의해 이루어집니다. 가장 일반적으로 아래 그림에서처럼 구배용출법을 이용하여 염(NaCl)으로 시료를 용출 시킵니다. 표적 단백질은 결합하는 동안 농축되며 정제되고 농축된 형태로 회수됩니다.
이온 교환기의 선택
강한 교환기부터 사용하여, 방법을 고안하는 동안 넓은 범위의 pH에 걸쳐 실험할 수 있도록 합니다.
강한 이온 교환기
Q(음이온 교환기), SP(양이온 교환기): 넓은 pH 범위(pH 2~12)에 대해 충분한 전하를 띰.
약한 이온 교환기
DEAE와 ANX(음이온 교환기), CM(양이온 교환기): 좁은 pH 범위(각각 pH 2~9, pH 6~10)에 대해 충분한 전하를 띠나 분리에 있어서 대체가능한 선택성을 부여합니다.
시료의 양과 용량
구배용출법을 이용한 최적의 분리를 위해 총 결합용량의 약 1/5 정도를 사용합니다. IEX는 시료의 양에 구애받지 않는 결합 방법입니다.
컬럼의 선택
Ion Exchange Selection Guide Code no: 18-1127-31을 참고하세요. 적절한 컬럼을 찾고 실험 방법을 최적화하기 위해 HiTrap™ IEX Selection Kit를 이용하세요.
시료 조제
시료는 출발 버퍼(starting buffer)과 같은 pH, 이온 강도를 가져야 하며, 입자상 물질(미세 먼지)이 없어야 합니다.
버퍼 조제
만일 전하 특성을 모른다면 다음과 같은 조건을 먼저 시도해봅니다.
- Anion Exchange
- Start buffer (A) : 20mM Tris-HCl, pH 7.4
- Elution buffer (B) : 20mM Tris-HCl + 1M NaCl, pH 7.4
- Gradient : 0-100% elution buffer in 10-20 column volumes
- Cation Exchange
- Start buffer (A) : 20mM Na₂HPO₄ X 2H₂O, pH 6.8
- Elution buffer (B) : 20mM Na₂HPO₄ X 2H₂O + 1M NaCl, pH 6.8
- Gradient : 0-100%B in 10-20 column volumes
